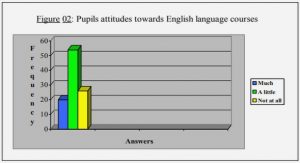
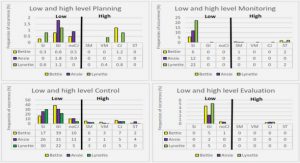
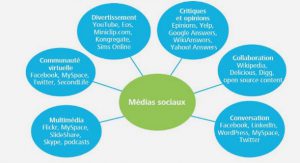
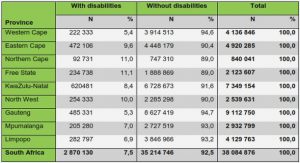
Get Complete Project Material File(s) Now! »
Enhancing intestinal permeability of nitric oxide with storable microparticles for S-nitrosoglutathione oral delivery.
Trois sortes de particules encapsulant du S-nitrosoglutathion (GSNO), un donneur physiologique de monoxyde d’azote, ont été préparées à partir des mêmes matériaux mais avec des procédés modifiés de double émulsion/évaporation de solvant : eau dans huile dans eau (E/H/E) ou solide dans huile dans eau (S/H/E). Les nano- et micro-particules obtenues par la méthode E/H/E ont été comparées aux microparticules obtenues par la méthode S/H/E en ce qui concerne leur taille, leur capacité à encapsuler le GSNO et à le libérer in vitro. La cytocompatibilité des particules vis-à-vis des cellules intestinales ainsi que leur capacité à améliorer la perméabilité intestinale du GSNO in vitro (modèle de barrière intestinale constituée par les cellules Caco-2 différenciées) ont été évaluées.
L’efficacité d’encapsulation du GSNO est la même (environ 30 %) pour les trois sortes de particules mais les microparticules (S/H/E > E/H/E) présentent un profil de libération plus lent du GSNO in vitro et améliorent significativement la perméabilité intestinale de GSNO. Cette perméabilité apparente élevée lorsqu’il est encapsulé dans les microparticules, associée à une solubilité élevée, fait passer GSNO en classe III de la classification biopharmaceutique.
La réduction de la taille des grains de GSNO (de 40 µm à moins de 10 µm) initiée en collaboration avec la société StaniPharm devrait, d’après la littérature, conduire à une meilleure encapsulation et à une libération prolongée de GSNO avec les microparticules S/H/E. Cependant, les premiers essais en fluide supercritique présentés dans cet article n’ont pas été concluants, à cause de la grande fragilité et de l’hydrophilie du GSNO.
Par ailleurs, les paramètres critiques des particules (taille et contenu en GSNO) sont maintenus jusqu’à 1 mois après lyophilisation et stockage à 4°C pour les microparticules et jusqu’à 3 mois pour les nanoparticules. Les suspensions fraîches de particules n’étant stables qu’une journée, cette stabilisation représente une avancée majeure, car elle permettra d’optimiser les campagnes de préparation des particules et de les envoyer éventuellement vers d’autres laboratoires pour la réalisation de tests précliniques. Les particules chargées en GSNO développées pourraient ainsi représenter une nouvelle opportunité thérapeutique pour un traitement chronique, par voie orale, des pathologies associées avec un déficit en monoxyde d’azote Pour conclure, les objectifs de ce travail étaient de mettre en évidence les mécanismes de la perméabilité intestinale de différents S-nitrosothiols et leur capacité à former un stock de NO mobilisable dans la paroi vasculaire, ainsi que de développer des formulations adaptées pour le traitement oral des maladies cardiovasculaires. Nous avons démontré : 1) que les trois RSNO étudiés peuvent être administrés par voie orale (avec une perméabilité intestinale moyenne) ; 2) qu’ils peuvent tous trois former un stock vasculaire de NO mobilisable pour une vasorelaxation ou pour induire une hyporéactivité à un agent vasoconstricteur. Tout ceci dans le cadre d’un endothélium lésé, ce qui est prometteur dans le contexte des maladies cardiovasculaires, souvent liées à une dysfonction endothéliale ; et 3) qu’il est possible d’augmenter significativement la perméabilité intestinale du GSNO grâce à des formulations, en particulier les microparticules obtenues par la méthode d’émulsion solide-huile-eau.
Ce travail ouvre de nombreuses perspectives à la fois pharmacologiques et galéniques. Par exemple, une localisation plus fine du stock vasculaire de NO ainsi qu’une identification des protéines nitrosées (par une technique de biotin-switch associée à la spectrométrie de masse, déjà développée dans l’équipe) pourrait être entreprise afin de mettre au jour de nouvelles cibles de NO. Idéalement, les méthodes analytiques devraient également permettre de réaliser une pharmacocinétique complète des RSNO administrés (libres ou formulés). En ce qui concerne la formulation, de nombreuses optimisations pourraient être recherchées (meilleure encapsulation, libération plus longue, encapsulation d’autres donneurs de NO – RSNO, amidoximes, ou autres-, co-encapsulation de différents principes actifs, modification des polymères par exemple avec des groupements donneurs de NO, …). Cependant, les formulations développées dans ce travail pourraient d’ores et déjà être administrées chez l’animal sain, pour vérifier la formation du stock vasculaire de NO, ou dans des modèles pathologiques (athérosclérose ou accident vasculaire cérébral, par exemple).
Nitric oxide
Nitric oxide (NO) is a gaseous radical, whose biosynthesis and cellular signaling mechanisms were discovered in the 1980’s1–4. As one of the most important signaling molecule, NO is involved in different organs and systems (such as cardiovascular system5,6, immune system2,3 and nervous system7) where it is responsible for modulating various effects8,9 (Figure 1). Among others, NO can be regarded as a potent vasodilator, a regulator of platelet adhesion, a neurotransmitter, an antimicrobial agent, a tumor mediator and an angiogenesis promoter10,11. Thus, researchers from different disciplines have proposed NO as a potential therapeutic.
As an important second messenger, NO is synthesized by three different isoforms of nitric oxide synthases (NOS): neuronal NOS (nNOS), inducible NOS (iNOS), and endothelial NOS (eNOS)12. nNOS was first discovered in neuronal tissue and eNOS in vascular endothelial cells. iNOS is the inducible isoform found in a wide range of tissues and cells. NO is constitutively generated by nNOS or eNOS at relatively small concentration (10 nM) for signaling. However, NO synthesized by the inducible isoform (iNOS), works as a response to inflammation, leading to high (more than 1 µM) and cytotoxic local concentrations of NO12,13. These three NOSs isoforms catalyze the synthesis of NO through a two-step reaction starting from L-arginine (L-Arg) transformed in an amidoxime intermediate, the N-hydroxy-L-arginine (NHA) to finally form L-citrulline and NO14 (Figure 2).
Nitric oxide and cardiovascular diseases (CVD)
Nitric oxide in the cardiovascular system
In cardiovascular system15–17, eNOS is mainly expressed in endothelial cells but also in platelets, cardiac myocytes and smooth muscle cells (SMCs); nNOS is basically expressed in the sarcoplasmic reticulum from cardiac myocytes, in autonomic cardiac neurons as well as ganglia or within vascular smooth muscle cells (VSMCs) (Figure 3). However, only under oxidative or pro-inflammatory conditions, iNOS will be expressed in a large range of cells such as endothelial cells, cardiac myocytes, nerve cells, VSMCs, leukocytes and fibroblasts. NO regulates cardiovascular system via two distinct pathways: one is the activation of the soluble guanylate cyclase (sGC) followed with the downstream stimulation of Protein Kinase G (PKG), and one direct pathway through proteins S-nitrosation (the binding of a NO moiety on a thiol group from a cysteine residue to form an RSNO).
In vessels, NO synthesized by eNOS triggers the relaxation of VSMCs as well as inhibits their proliferation17,18. After its diffusion to the vessel lumen, it also mediates angiogenesis and inhibits platelet aggregation and thrombosis.
In erythrocytes, NO reacts with the Fe2+ heme of oxyhemoglobin and produce nitrate ions. Then, the nitrate reductase existing in mammalian tissues reduces nitrate ions (NO3−) to nitrite ions (NO2−). In fact, deoxygenated hemoglobin has a nitrite reductase activity, which reduces NO2− to NO in hypoxic and acidic environments. In addition, reversible S-nitrosation of the Cys 93 of hemoglobin might transport NO for its subsequent release in hypoxic tissues. The reduction of NO2− and/or S-nitrosation of hemoglobin promotes NO release followed by-immediate relaxation of hypoxic tissues19. The diffusion and bioavailability of NO in VSMCs are regulated by hemoglobin-α (Hb-α) at the myoendothelial junction and by cytoglobin in muscle cells. In addition, NO synthesized through nNOS in the VSMCs also help to regulate the vascular tone20–22.
In cardiac myocytes, the main roles of NO are the regulation of cardiac contractility through the modulation of the excitation–contraction coupling, relaxation, and mitochondrial respiration. In addition, the action of nNOS expressed in cardiac nerves and postsynaptic eNOS can reinforce the parasympathetic (vagal) transmission through modulating the sympathetic–parasympathetic balance, which finally reduces the heart rate18.
NO signaling in vascular beds in health and disease.
Under physiological conditions (Figure 4a), NO synthesized by eNOS inhibits platelet aggregation and thrombosis. Basically, NO activates soluble guanylate cyclase in VSMCs by coordination to the ferrous prosthetic of the heme moiety (which is nitrosylation) which converts the guanosine-5’-triphosphate (GTP) to cyclic guanosine monophosphate (cGMP). Then, the PKG will be activated in the SMCs. Both cGMP and PKG lowered the intracellular Ca2+ levels through stimulating its reuptake by sarcoplasmic/ endoplasmic reticulum calcium-ATPase and its extrusion through the plasma membrane calcium-transporting ATPase15. In addition, the efflux of K+ will also be triggered by PKG through the large-conductance Ca2+-sensitive potassium channel, which will hyperpolarize the cell and reduce Ca2+ entry through the L-type calcium channel. At last, PKG promotes the dephosphorylation of the myosin light chain through the associated phosphatase. Together these modifications mediate vasorelaxation. Perivascular adipose tissue (PVAT) contributes to this effect under healthy conditions by releasing NO and adiponectin, which activates NO production in SMCs15,18,21.
Table of contents :
Chapter 1. Introduction
1.1 Nitric oxide
1.2 Nitric oxide and cardiovascular diseases (CVD)
1.2.1 Nitric oxide in the cardiovascular system
1.2.2 NO signaling in vascular beds in health and disease. .
1.3 NO storage
1.4 Nitric oxide donors
1.4.1 Direct Donors
1.4.2 Donors Requiring Metabolism
1.4.3 New NO donors
Article 1: Synthesis of Novel Mono and Bis Nitric Oxide Donors with High Cytocompatibility and Release Activity
The stability and biological chemistry of RSNOs
1.5 GSNO
1.5.1 Chemical Synthesis of GSNO
1.5.2 In vitro stability
1.5.3 In vivo metabolism
1.6 GSNO related delivery systems and therapeutic potentials
1.6.1 Intravenous administration
1.6.2 Topical administration
1.6.3 Implants
1.6.4 Oral administration
1.6.5 Gastrointestinal barrier:
1.7 Nanoparticles/microparticles for oral delivery of biological molecules
1.7.1 Nanoparticles targeting the gastrointestinal tract
1.7.2 Microparticles for oral delivery
Chapter 2: Intestinal permeability of S-nitrosothiols
2.1 Transport mechanism through intestinal barrier
2.2 Intestinal permeability measurement with Caco-2 cell monolayer model
2.3 Biopharmaceutical Classification System
Article 2: Intestinal absorption of S-nitrosothiols: permeability and transport mechanisms
Chapter 3: Vascular NO storage and its vasoactivity
3.1 NO storage
3.2 Endothelial dysfunction
Article 3: S-nitrosothiols as potential therapeutics to induce a mobilizable vascular store of nitric oxide to counteract endothelial dysfunction.
Chapter 4: Nano or micro? Three different particles to deliver GSNO through oral route. Eudragit® RL PO
Double emulsion (W/O/W and S/O/W)
Water in oil in water (W/O/W) double emulsion
Solid in oil in water (S/O/W) double emulsion
Article 4: Three different particle types to protect and deliver S-nitrosoglutathione: nanoparticles, water-in-oil-in-water microparticles and solid-in-oil-in-water microparticles
General discussion, conclusions and perspectives